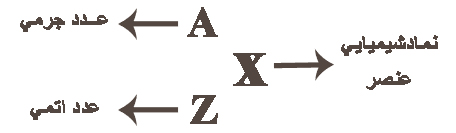اگر با جدول تناوبی عناصر آشنا باشید، خواهید دانست که این جدول ویژگی تمامی عناصر سازنده دنیای اطرافمان را به خوبی توضیح داده است. عناصری که در ستون اول این جدول قرار گرفتهاند، شدیدا با آب واکنش میدهند. یا اینکه ستون آخر جدول، گازهایی هستند که به سختی با دیگر عناصر واکنش میدهند. اما جالب است بدانید که هریک از این عناصر نیز به دستههای مختلفی تقسیم میشوند. در حقیقت برای هر عنصر مفهومی تحت عنوان ایزوتوپ تعریف میشود. در ادامه این مفهوم را به تفصیل توضیح خواهیم داد.
ایزوتوپ
یک اتم از هستهای با چگالی بالا و الکترونهای اطرافش تشکیل شده است. این تصویری است که مدل اتمی بور برای اولین بار، آن را ترسیم کرده است. هسته اتم نیز از دو جزء اصلی نوترون و پروتون تشکیل شده است.
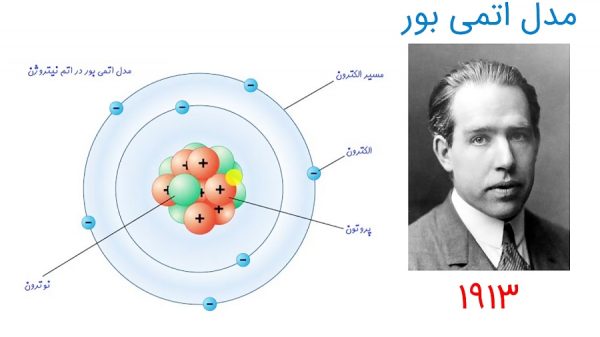
شکلی از اتم که امروزه در ذهن بشر شکل گرفته مدل اتمی است که نیلز بور فیزیکدان دانمارکی در سال ۱۹۱۳ ارائه داد .
پروتون و نوترون را میتوان دو مولفهی مشابه از یک اتم دانست. در حقیقت تنها یک ویژگی است که این دو اِلِمان را از یکدیگر مجزا میکند. این ویژگی بار الکتریکی آنها است. پروتون ذرهای با بار مثبت و نوترون ذرهای خنثی محسوب میشود. این تفاوت در بار الکتریکی باعث میشود تا پروتون میدان مغناطیسی و میدان الکتریکی را حس کند، ولی نوترون واکنشی نسبت به آنها نداشته باشد.
الکترون نیز که جرمی بسیار کمتر از پروتون و نوترون دارد، دارای باری برابر با پروتون ولی با اندازهی منفی است. بنابراین اتمی که اندازه الکترونها و نوترونها در آن برابر باشد، بارش نیز خنثی خواهد بود. توجه داشته باشید که این تعداد الکترونهای یک اتم است که رفتار شیمیایی یک عنصر خاص را تعیین میکند.
ایزوتوپهای یک عنصر دارای تعدادی برابر از پروتون بوده و تنها تعداد نوترونهای آنها با یکدیگر متفاوت است. بهمنظور بیان کردن ایزوتوپها کنار یکدیگر در ابتدا نام عنصر عنوان شده و پس از آن جرم اتمی آن را بیان میکنند. برای نمونه ایزوتوپهای کربن را در نظر بگیرید. تاکنون ۳ ایزوتوپ از کربن در طبیعت یافت شده است. کربنِ ۱۲، ۱۳ و ۱۴ ایزوتوپهای کربن هستند. اعداد بیان شده در جلوی نام کربن، بیان کننده جرم هریک از آنها است. هر ۳ این کربنها دارای تعدادی برابر از پروتون بوده ولی تعداد نوترونهای آنها متفاوت است. تعداد نوترونهای آنها به ترتیب برابر با ۶، ۷ و ۸ است.
از دیدگاه شیمیایی ویژگی هر ۳ ایزوتوپ کربن مشابه است، چرا که تعداد الکترون در آنها یکسان است. بنابراین ایزوتوپهای یک عنصر از نظر شیمیایی رفتاری یکسان دارند. جالب است بدانید برخی از عناصر با تغییر کامل به عنصری دیگر، این قانون را زیر پا میگذارند.
پایداری
قابلیت تغییر ماهیت در اتمها منجر میشود تا ایزوتوپها را با ناپایداری مواجه کند. این مفهومی است که کشف آن، جایزه نوبل را در سال ۱۹۲۱ برای «فردریک سودی» (Frederick Soddy) به ارمغان آورد.
برخی از ایزوتوپها همچون کربنِ ۱۲، همواره وجود دارند و تنها در شرایطی خاص تغییر ماهیت میدهند. این در حالی است که کربن ۱۴ حالتی ناپایدار داشته و به ایزوتوپی پایدار از عنصری دیگر تبدیل میشود.
برای نمونه کربن ۱۴ با تغییر در تعداد پروتونهایش به نیتروژن ۱۴ تبدیل میشود. در این فرآیند که تحت عنوان «فروپاشی بتا» (Beta Decay) شناخته میشود، هستهی اتم امواجی از جنس الکترون و آنتی نوترون ساطع کرده و تعداد پروتونهایش افزایش مییابد. با افزایش یک پروتون در هسته، اتم تغییر ماهیت داده و به ایزوتوپی پایدار از عنصر نیتروژن تبدیل میشود.
عوامل زیادی در فروپاشی هستهی یک اتم وجود دارد. یکی از مهمترینِ آنها، نسبت تعداد پروتونها به تعداد نوترونها در هسته اتم است. اگر یک هسته اتم، دارای تعداد زیادی نوترون باشد (تعریف اینکه منظور از تعداد زیاد چقدر است، وابسته به جرم هسته بوده و نمیتوان مرز مشخصی را تعریف کرد)، احتمال فروپاشی آن به سمت تبدیل شدن به ایزوتوپی پایدار، زیاد خواهد بود.
در حالتی که تعداد پروتونهای هسته نیز زیاد باشد، فرآیند فروپاشی میتواند رخ دهد. فروپاشی عاملی است که منجر به رادیوالکتیو شدن برخی از ایزوتوپهای یک عنصر میشود.
در حالت کلی حدود ۳۳۹ هسته اتمی متفاوت روی زمین وجود دارد که ۲۸۶ مورد از آنها «نوکلید دیرینه» (Primordial Nuclide) محسوب میشوند. نوکلویدها ایزوتوپهایی هستند که واپاشی آنها بسیار کند بوده به نحوی که عمر آنها از عمر زمین نیز بیشتر است.
نماد استفاده شده برای اتم
معمولا هسته هر اتم را با استفاده از دو عدد توصیف میکنند. عدد اتمی که معیاری از پروتونها و عدد جرمی که با استفاده از آن میتوان میان ایزوتوپها تمایز قائل شد.
عدد اتمی
عدد اتمی نشان دهنده تعداد پروتونهای یک اتم است. با توجه به این تعریف، برای یک اتم خنثی میتوان عدد اتمی را برابر با تعداد الکترونها نیز در نظر گرفت؛ چرا که تعداد الکترونها و پروتونها در یک اتم خثنی با یکدیگر برابر است. بنابراین برای یک اتم خنثی میتوان گفت:
تعداد الکترونها = تعداد پروتونها = عدد اتمی
معمولا عدد اتمی را در سمت چپ و پایین عنصر نمایش میدهند. توجه داشته باشید که در اکثر متون علمی، عدد اتمی را با نماد Z نمایش میدهند.
عدد جرمی
عدد جرمی معیاری از میزان جرم اتم است. با توجه به اینکه بخش بسیاری از جرم یک اتم در هسته آن قرار گرفته، بنابراین مجموع جرم نوترون و پروتون به عنوان عدد جرمی در نظر گرفته میشود. بنابراین میتوان گفت:
تعداد نوترونها + تعداد پروتونها = عدد جرمی
در بسیاری از موارد عدد جرمی با نماد A نشان داده میشود.
بار الکتریکی
یک اتم میتواند الکترون گرفته یا از دست بدهد. با توجه به این که بار یک اتم با استفاده از برآیند بار الکترونها و پروتونها تعیین میشود، لذا با تغییر تعداد الکترونها بار اتم نیز تغییر کرده و در سمت راست و بالای اتم نوشته میشود.
برای بدست آوردن بار الکتریکی یک اتم تعداد پروتونها از تعداد الکترونها کم میشود. در این صورت اگر تعداد الکترونهای یک اتم کم شود، بار اتم مثبت و اگر الکترونهای اتم افزایش یابد، بار اتم منفی خواهد شد. در نتیجه رابطه زیر در مورد بار یک اتم برقرار است.
تعداد الکترونها – تعداد پروتونها = بار اتم
لینک کوتاه